S'amuser à apprendre: des explications simples en quelques dizaines de ligne sur les concepts scientifiques et des projets et tutoriels en électronique, domotique, informatique, rétrogaming, etc.
31 Octobre 2018
Vous vous êtes peut-être déjà demandé comment les scientifiques arrivent à connaitre la composition chimique des étoiles ou des planètes distantes, juste en les observant à travers un télescope ? Voici deux de ces méthodes qui, vous allez le voir, ne sont pas si compliquées à comprendre.
Les atomes sont constitués d'un noyau accompagné d'électrons répartis sur des "couches" (on parle de "niveau d'énergie").
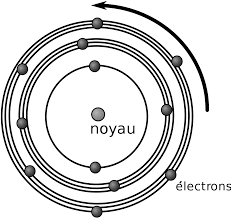
Quand un atome reçoit de l'énergie, un ou plusieurs électrons montent d'une couche vers la couche supérieure, puis ces électrons repartent immédiatement vers leur couche de départ en émettant un photon, vecteur de la force électromagnétique. Le photon émis porte l'énergie exacte qui a été donné à l'électron pour "monter" d'une couche. L'énergie d'un photon lui donne sa fréquence, et si cette fréquence est dans la plage de fréquence de la lumière visible, sa "couleur".
Lorsque l'on analyse la lumière émise par un atome auquel on apporte de l'énergie, on peut compter les photons émis et leur fréquence (ou couleur) respective, puis en déduire une signature caractéristique de cet élément.
Ci-dessous, l'exemple de la signature caractéristique du gaz appelé néon (celui que l'on trouve dans les éclairages du même nom), où l'on peut observer des pics d'émission de photon (en ordonnée) à plusieurs fréquences précises (en abscisse).

Un corps céleste, comme une étoile par exemple, est composé de plusieurs types d'atome. La lumière que ce corps céleste va émettre ou réémettre sera donc un mélange de toutes les signatures des atomes qui le composent. On parle de spectre d'émission.
Ci-dessous, le spectre d'émission de l'hydrogène, composé de 4 pics (les barres lumineuses).

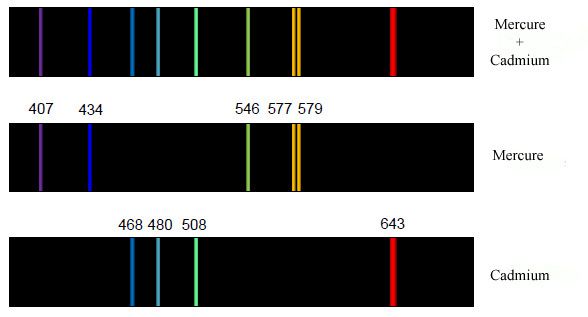
Ci-dessous, exemple d'un spectre émis par un corps qui serait composé uniquement de mercure et de cadmium. Les nombres indiqués correspondent à la fréquence des photons (en nm pour nanomètre), et donc à la couleur.
Le deuxième phénomène est très voisin. Quand des photons heurtent les atomes d'un corps, seuls sont absorbés les photons dont la fréquence correspond à l'énergie nécessaire pour qu'un électron de l'atome heurté saute de couche. Ces photons disparaissent en donnant leur énergie à l'atome heurté. Les autres photons sont renvoyés et donnent ses couleurs à l'atome heurtés, et donc au corps. Dans la lumière émise par un corps, il va donc manquer toutes les fréquences de photon qui correspondent aux signatures des atomes présents dans le corps.
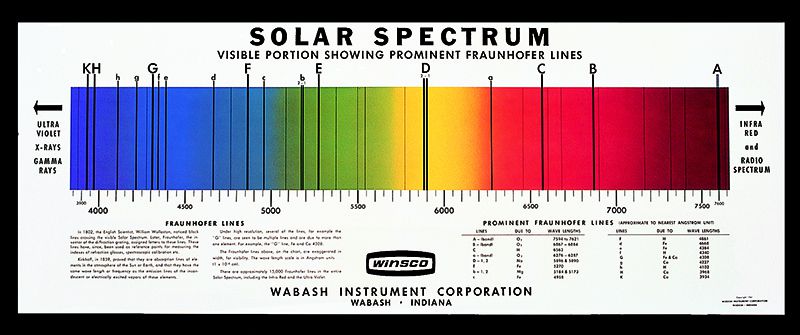
Sur le graphique ci-dessous, chaque barre noire correspond à un pic d'absorption de photon à une fréquence précise (ici dans la gamme de fréquence correspondant à la lumière visible). On appelle ce diagramme les "raies de Fraunhofer" et il correspond au spectre lumineux émis par notre soleil, auquel il manque les fréquences correspondant aux atomes présents dans notre atmosphère terrestre. Il s'agit ici d'un spectre d'absorption.
http://science-facile.fr/article-l-auteur-de-ce-blog-52994158.html
Voir le profil de Sly sur le portail Overblog